Od poloviny 20. století se zvyšuje počet pacientů trpících zhoubnými onemocněními, a to do té míry, že před nástupem epidemie COVID-19 byly maligní tumory druhou nejčastější příčinou úmrtí. Tento nepříznivý trend se projevuje zejména v rozvinutých zemích s vyspělou a široce dostupnou zdravotní péčí. V České republice se v současnosti se zhoubným onemocněním setká v průběhu svého života každý druhý obyvatel. To ale nutně neznamená, že toto onemocnění bude také příčinou jeho úmrtí. V léčbě nádorů totiž dosáhla medicína díky mezioborovému a mezinárodnímu výzkumu významných pokroků. Mnoho pacientů tak může být zcela vyléčeno nebo jejich onemocnění může být úspěšně kontrolováno.
Není zcela jasné, proč jsou v současnosti nádory tak velmi časté. Podezřívána je řada faktorů: změny životního stylu, zvýšený přísun kalorií v potravě nebo znečištění životního prostředí. Tyto převážně zevní vlivy jsou skutečně z velké části zodpovědné za zvýšený výskyt malignit. Populárně řečeno, rakovina je dnes mnoha lidmi vnímána jako civilizační choroba. Jsou ale tyto vlivy jediným důvodem nárůstu incidence malignit v lidské populaci? Patrně ne.
Významným, ne-li dokonce hlavním viníkem, se totiž zdá být stárnutí obyvatelstva. Z epidemiologických studií vyplývá, že nejčastější je výskyt malignit ve vyšším věku, zejména nad 65 let. Toto dožití je vedle řady jiných faktorů podmíněno primárně úrovní a dostupností kvalitní zdravotnické péče. Nádory se pak zdají být určitou daní za zvýšení průměrného věku dožití. Z kauzálního pohledu se prostředí, ve kterém žijeme, jistě mění. Lidstvo se ale mění také – stárne.
Ze zhoubných onemocnění se stává stále významnější problém, a to nejen zdravotnický, ale i sociální a ekonomický. Léčba a péče o seniorní pacienty musí zohledňovat jejich určitou zranitelnost a křehkost (anglicky frailty). Nelze se proto divit, že vědci na celém světě hledají nové cesty, jak zlepšit prevenci a diagnostiku nádorů a zvýšit efektivitu léčby za podmínek finanční udržitelnosti zdravotnických systémů.
Nádor jako ekosystém
Velmi dlouho byl nádor chápán jako de facto genetické onemocnění klonálně vycházející z nádorové buňky. Nádorový charakter taková buňka získává díky vrozené nebo později získané a neopravené mutaci DNA. Ve skutečnosti ale takových mutací bývá před propuknutím nádorového onemocnění potřeba získat a neopravit mnoho. Kumulaci mutací v genomu cílové buňky mohou usnadnit další faktory jako například virová infekce, která mimo jiné dokáže vyřadit některé z regulačních mechanismů chránících genetickou integritu buňky. Takový úzce fokusovaný pohled do patofyziologie malignit objasnil mnoho buněčných mechanismů, a dokonce umožnil etablovat i některé léčebné postupy terapeuticky zamířené přesně na mutovanou nádorovou populaci. V praxi ale takové „kouzelné kulky“ bývají drahé a – bohužel – často selhávají (poznámka: termín a koncept „zázračné kulky“ v terapii lidských onemocnění pochází od Paula Ehrlicha, 1907).
V pozdějších letech proto pohled na nádor začal být integrativní. Kromě vlastní mutované populace buněk totiž nádor obsahuje i mnoho buněk, které nejsou mutovány, ale významně se při průběhu nádorového onemocnění uplatňují. Pro tyto „ostatní“ složky nádoru se vžilo souhrnné označení stroma. Dnes je tedy nádor chápán spíše jako komplexní orgán nebo ekosystém a pro popis událostí uvnitř nádoru je možné používat terminologii známou z makrosvěta krajinné a populační ekologie. Nádorovou buňku totiž obklopuje v tumoru řada dalších buněčných typů, které s ní mohou interagovat rozličnými způsoby. Jmenovitě jsou to buňky imunitního systému, které ale často místo aby nádorovou buňku likvidovaly, spíše její proliferaci podporují. Dále jsou to nádorově asociované fibroblasty, které se podobají aktivovaným myofibroblastům. Tyto fibroblasty pak místo tvorby fyzické bariéry invazi nádorových buněk nejen umožňují, ale paradoxně ji i vedou. Kolektivně buňky stromatu spolu s vlastní nádorovou populací představují jakési komunikační centrum nádoru. Do popředí pak vystupují spíše než samotné jednotlivé populace jejich vzájemné interakce.
Nádorová buňka v kontextu tumoru ale může být stále chápána jako princeps inter pares, tedy první mezi rovnými. Stroma totiž musí být ke své podpůrné funkci nejprve rekrutováno a vycvičeno. Například nádorově asociované fibroblasty vznikají pod vlivem nádorové buňky nejčastěji přímo z lokálních fibroblastů nacházejících se v její bezprostřední blízkosti. Velmi zajímavá je skutečnost, že z cytologického hlediska se stroma nádoru výrazně podobá granulační tkáni, která je důležitou součástí hojící se rány. Myofibroblasty exprimující hladkosvalový aktin nejen že přispívají ke kontrakci rány, ale svými uvolňovanými aktivními působky stimulují její hojení až po finální reepitelizaci. Podobně nádorově asociované fibroblasty také stimulují migraci a proliferaci nádorových buněk. Extracelulární matrix a přítomné aktivní molekuly tak vytvářejí specifické nádorové mikroprostředí, které nádorové buňce poskytuje optimální podmínky pro její přežití. Bez svého mikroprostředí je pak nádorová buňka snadno zranitelná. Je tedy evidentní, že nádorová buňka v kontextu vzniku nádoru sehrává prim, ale v dalších krocích postupu rozvoje nádorového procesu již stroma není jen druhořadým hráčem a skýtá nezanedbatelný terapeutický potenciál: Kouzelné kulky nemusí mířit pouze na nádorové buňky, mohou cílit i na zkorumpované buňky nádorového mikroprostředí.
Jak spolu buňky nádorového ekosystému komunikují?
Buňky se ve tkáních spolu navzájem dotýkají a mohou se tak ovlivňovat. Mnohem významnější je ale patrně ovlivňování nepřímé, které zprostředkovávají z buněk uvolňované signály představované biologicky aktivní působky, nejčastěji proteinové povahy. Buňky tedy mohou mezi sebou vzájemně komunikovat v nádorovém mikroprostředí i bez přímého kontaktu, parakrinně. Je zajímavé, že řada z takových signálních molekul jsou proteiny podporující zánět, zejména pak interleukiny IL-6 a IL-8. Právě tyto signály jsou v tumoru významně produkovány nádorově asociovanými fibroblasty. Prozánětlivé cytokiny se podílejí na udržování nádorové buňky v aktivním stavu, což umožňuje například udržet si nízký diferenciační stupeň, udržet si schopnost neomezeného dělení anebo posílit tendenci k migraci. Tak vzniká nejnebezpečnější komplikace nádorového onemocnění – metastáza.
Tyto faktory se ale navíc přes cévní kapiláry v nádoru dostávají i do krevního oběhu, který je zanese i do vzdálených částí těla. Tím se ale podstatně mění i styl komunikace a z tumoru uvolňované látky se stávají endokrinními signály. Tyto signály působící i na velké vzdálenosti vytvářejí vhodné podmínky pro následné přijetí migrující nádorové buňky ve vzdáleném orgánu. Opět s poukazem na zavedenou ekologickou terminologii označujeme takové příhodně připravené místo v cílové tkáni jako premetastatickou niku.
Dlouhodobě zvýšená hladina bioaktivních faktorů významně ovlivňuje ale celý organismus pacienta. Nádory je tedy vhodné pro účely smysluplné terapie vnímat jako systémové choroby. Signály uvolňované nádorem působí pak na funkci jaterních buněk, tukovou tkáň či vlákna kosterního svalu. Organismus pod vlivem těchto signálů chátrá a dostavuje se kachexie. Kromě toho tyto bioaktivní působky pronikají i do mozku, kde nádorový signál ovlivňuje chování pacienta, což vede ke klinicky manifestním poruchám nálady, zejména depresivním stavům. V hypothalamu působení cytokinů pak navozuje i poruchy příjmu potravy. Tyto vlivy pak synergicky vedou až k rychlému úmrtí pacienta.
Nádorové exosomy – informace sbalená na cesty
Vedle malých signálních molekul jsou v poslední době v souvislosti s výměnou informací mezi populacemi spoluvytvářejícími nádor studovány jako významný komunikační nástroj takzvané exosomy. Jedná se o velmi malé váčky velikosti nepřesahující pouhých 150 nanometrů (pětina vlnové délky červeného světla). Tyto nanovezikuly jsou tvořené buněčnou membránou obsahující náklad zahrnující kromě řady možných proteinů i informační molekuly, například mikroRNA. Právě tento obsah nukleových kyselin v exosomech činí z těchto mediátorů mezibuněčné komunikace velmi účinný nástroj s obrovským regulačním potenciálem vůči cílové struktuře. Navíc jde o nástroj s potenciálně dlouhodobým působením, než jaké lze očekávat například od proteinů relativně krátkodobě interagujících s buněčnými receptory.
Jakkoli existuje již velká suma poznatků o vlivu exosomů na vlastní nádorové buňky, je známo výrazně méně o jejich vlivu na stroma nádoru. A právě tento aspekt vlivu nádorových exosomů na nádorově asociované fibroblasty byl předmětem výzkumu vedeného prof. Karlem Smetanou Jr. z Anatomického ústavu 1. lékařské fakulty Karlovy univerzity podpořeného grantem GA ČR. Kromě odborníků z 1. lékařské fakulty a Přírodovědecké fakulty UK se na výzkumu podíleli také vědci z Ústavu molekulární genetiky AV ČR. Vzhledem k vysoké finanční náročnosti, byl tento výzkum významně spolufinancován i z prostředků Centra nádorové ekologie (CNE). Projekt CNE konsorcia vedeného profesorem Smetanou byl vybrán k financování v rámci Operačního programu Výzkum, Vývoj, Vzdělávání hrazeného z prostředků Evropské unie.
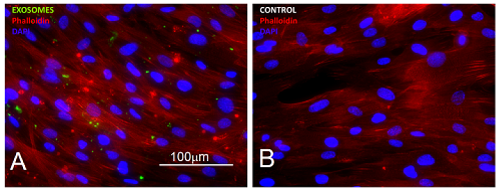 Obr. 1) Nádorově asociované fibroblasty (A, B) jsou znázorněné pomocí interakce F-aktinu s phalloidinem značeným rhodaminem (červený signál), jádra jsou znázorněna DAPI. Exosomy produkované nádorovými buňkami značené GFP (zelený signál; A) se vážou na fibroblasty. Měřítko je 100 mm.
Obr. 1) Nádorově asociované fibroblasty (A, B) jsou znázorněné pomocí interakce F-aktinu s phalloidinem značeným rhodaminem (červený signál), jádra jsou znázorněna DAPI. Exosomy produkované nádorovými buňkami značené GFP (zelený signál; A) se vážou na fibroblasty. Měřítko je 100 mm.
V průběhu tohoto projektu se podařilo pro výzkum nejprve vyvinout postup pro reprodukovatelnou izolaci exosomů v dostatečné čistotě a množství. Exosomy byly produkovány za striktně definovaných podmínek kulturami buněk linie maligního kožního melanomu. Metodou komparativní buněčné analýzy byl charakterizován vliv exosomů na normální kožní fibroblasty a nádorově asociované fibroblasty v podmínkách tkáňové kultury (obr. 1). Bylo zjištěno, že exosomy z melanomových buněk významně snižují adhezivitu a rozprostření obou typů fibroblastů. Na druhou stranu se tyto změny logicky odrážejí i ve zvýšení schopnosti fibroblastů migrovat ve 3D kolagenních gelech. Pomocí RNA sekvenace byl sledován vliv produkovaných exosomů na celogenomový transkripční profil obou typů fibroblastů. Poněkud překvapivě nebyl efekt přidaných exosomů zcela bezprostřední; větší rozdíly byly totiž pozorovány až ve střednědobém horizontu několika dnů. To může naznačovat právě dlouhodobější vliv, který exosomy v průběhu nádorového procesu sehrávají.
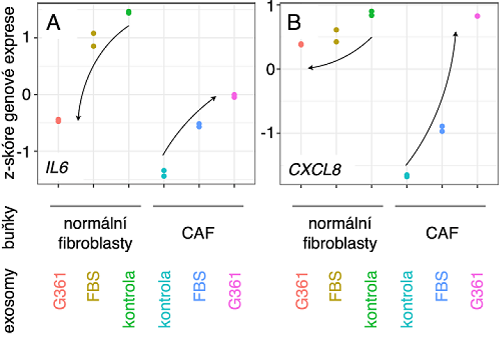
Obr. 2) Po ovlivnění exosomy z nádorových buněk dochází ke kvalitativně odlišným změnám v genové expresi prozánětlivých interleukinů IL6 (A) a CXCL8/IL8 (B) v normálních kožních fibroblastech a v nádorově asociovaných fibroblastech (CAF). Buňky byly ovlivněny buď exosomy z nádorových buněk (EXO G361), exosomy z hovězího fetálního séra (FBS) nebo nebyly ovlivněny (kontrola).
Na úrovni mRNA byl po ovlivnění exosomy zjištěn nápadný rozdíl v expresi genů odpovědných za zánětlivou odpověď. Za obzvláště významné je možno považovat skutečnost, že aktivita genů kódujících IL-6 a IL8 se po aplikaci exosomů nádorově asociovaným fibroblastům zvýší, a naproti tomu se u normálních fibroblastů sníží (obr. 2). Tato skutečnost byla ověřena i na proteinové úrovni pomocí protilátkových arrayí a kvantifikována pomocí metody ELISA. Naproti tomu ale exosomy ovlivňují v některých rysech chování fibroblastů obecně. Byla nalezena například podobná odpověď obou typů buněk na aplikaci exosomů v oblasti produkce a organizace mezibuněčné hmoty.

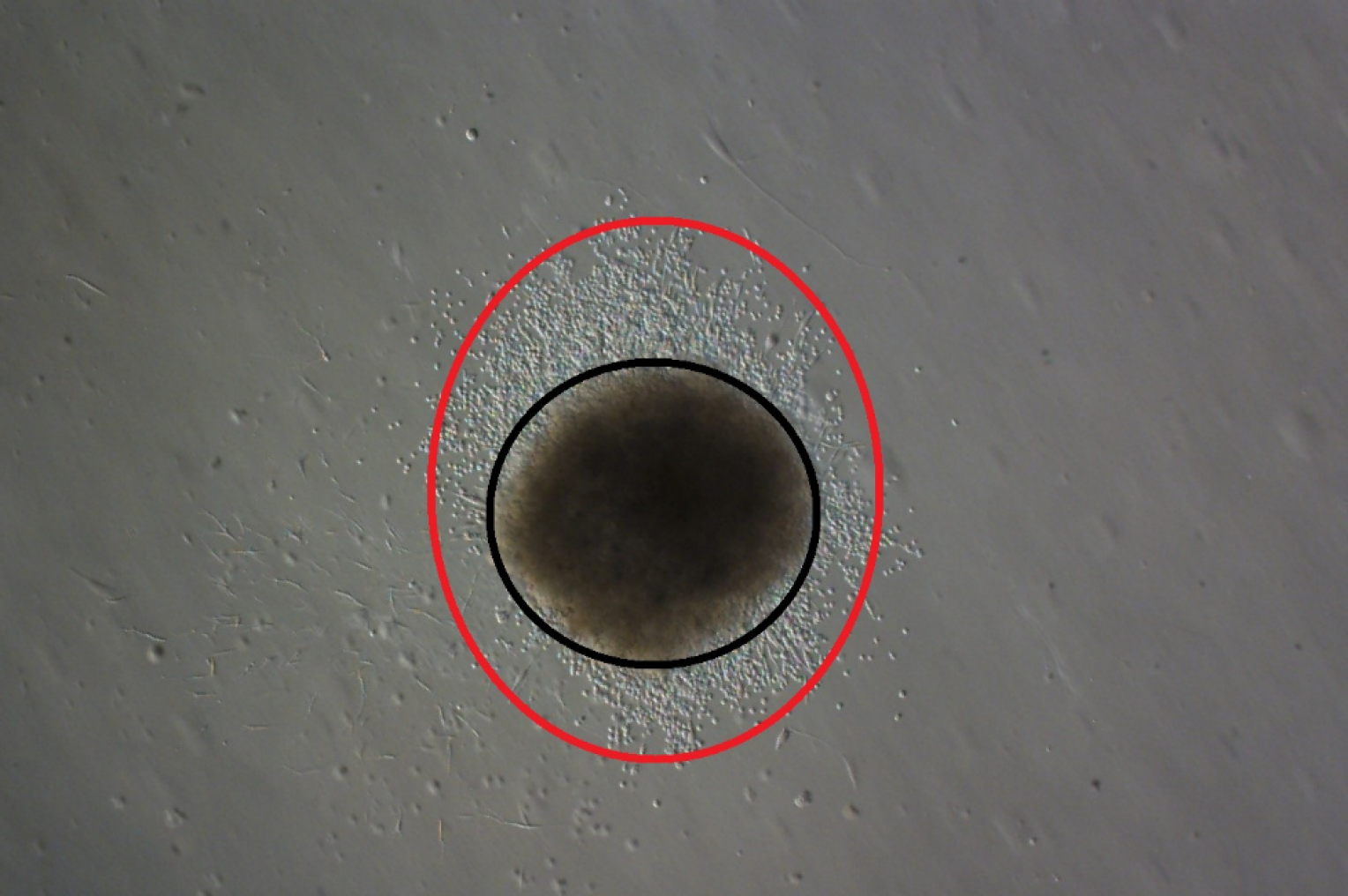
Obr. 3) Melanomové buňky migrují ze sfér tvořených buňkami melanomu a nádorově asociovanými fibroblasty v kolagenním gelu obsahujícím exosomy produkované nádorovými melanocyty. Obvod sféry je vyznačen černě a hranice migrace je červená, měřítko je 1 mm.
Dále bylo ověřeno na 3D modelu, že exosomy z nádorových buněk se mohou významně podílet na regulaci chování buněk při invazi do jimi obohacené extracelulární matrix. Přidání exosomů do kolagenního gelu totiž urychluje migraci buněk melanomu ze sféroidních modelů vytvořených z fibroblastů a buněk melanomu (obr. 3). Migrace byla opět výraznější ze sfér, které obsahovaly nádorově asociované fibroblasty než z těch, ve kterých byly použity kontrolní kožní fibroblasty. Tato skutečnost jasně indikuje podíl exosomů a nádorově asociovaných fibroblastů nejen při lokálně invazivním postupu růstu nádoru, ale i při vzniku metastáz. Exosomy tak lze zjednodušeně přirovnat k nosičům souboru instrukcí, pomocí kterých nádorové buňky mohou přizpůsobovat mikroprostředí ke svým potřebám a usnadňovat si tak i cestu okolí i do vzdálených míst organizmu.
Exosomy produkované maligními buňkami melanomu ovlivňují v mnoha aspektech chování dermálních fibroblastů. Exosomy ale v některých aspektech aktivují odlišně nádorově asociované fibroblasty a normální kožní fibroblasty. Tyto rozdíly nejsou pouze kvantitativní, ale i kvalitativní. Provedené experimenty prokázaly jasnou souhru parakrinního působení nádorových buněk a jimi produkovaných exosomů zejména na nádorově asociované fibroblasty. Exosomy aktivované nádorově asociované fibroblasty pak v opačném směru regulace navádějí nádorové buňky při invazi do extracelulární matrix, a zvyšují tak jejich migrační potenciál. To může vést ke klinicky významným projevům, jako je lokální invaze a destrukce, nebo zakládání vzdálených metastáz. Přerušení této maligní komunikace mezi nádorovými a stromálními buňkami může být novou terapeutickou modalitou u rakovinných onemocnění.
Prof. MUDr. Karel Smetana, DrSc., promoval na Fakultě všeobecného lékařství Karlovy Univerzity v roce 1983. V Anatomickém ústavu 1. lékařské fakulty Karlovy Univerzity v Praze a v Biotechnologickém a biomedicínském centru Akademie věd ČR a Univerzity Karlovy (BIOCEV) ve Vestci se věnuje buněčné biologii, v poslední době zejména interakci nádorových a nenádorových buněk ve zhoubných nádorech. Je vědeckým koordinátorem projektu Centrum nádorové ekologie. Publikoval 245 odborných článků, 17 kapitol v odborných monografiích a učebnicích a 11 patentů. Jeho Hirschův index je 34. Působí v redakčních radách řady mezinárodních časopisů. Jeho práce byla odměněna cenou Česká hlava a Cenou ministra školství, mládeže a tělovýchovy České republiky za výzkum. Je voleným členem České lékařské akademie.
